Ammonium
In dit artikel duiken we in de fascinerende wereld van Ammonium, waarbij we de verschillende dimensies ervan en de impact ervan op het dagelijks leven onderzoeken. Vanaf zijn oorsprong tot zijn evolutie in de loop van de tijd is Ammonium het voorwerp van belangstelling en studie geweest in verschillende disciplines. We zullen de relevantie ervan in de huidige context analyseren, evenals de verschillende perspectieven die rond dit onderwerp bestaan. Via een multidisciplinaire aanpak zullen we proberen licht te werpen op weinig bekende aspecten van Ammonium, met als doel een brede en verrijkende visie te bieden op dit onderwerp van algemeen belang.
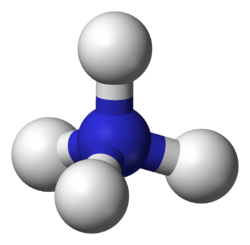
Ammonium is een eenwaardig polyatomisch kation met samenstelling NH4+. Het is het geconjugeerde zuur van ammoniak. Het ammoniumion is een zwak zuur. In een basisch milieu zal het zich als een zuur gedragen en een H+-ion afsplitsen. In een meer neutraal en zuur milieu zal het waterstofion aan het ammoniumion gebonden blijven.
In de organische chemie komen ammoniumionen ook voor. In deze ionen zijn een of meer van de waterstofionen door koolstofgroepen vervangen.
Chemische achtergrond
De chemische verbinding kan men zich als volgt voorstellen:
Het vrij elektronenpaar van de stikstof (N) in ammoniak wordt weergegeven als een paar stippen. Dit elektronenpaar vormt een binding met een waterstofion (H+).
In zijn reacties lijkt het ammoniumion erg op natrium- en kaliumionen. Net als die ionen komt ammonium voor als eenwaardig kation NH4+. Veel alkalimetaalzouten kennen een variant, waar het ammoniumion de plaats inneemt van een alkalimetaalion. Net als deze zouten zijn ook de ammoniumzouten vrijwel altijd goed oplosbaar.
Anders dan bij de alkalimetalen kan ammonium niet door reductie uit een zout vrijgemaakt worden:
De reductie resulteert in een onmiddellijke ontleding, waarbij ammoniak en waterstof gevormd worden.
Nog een verschil met de alkalimetaalzouten is dat als het negatieve ion oxiderende eigenschappen heeft, het zout door verhitting makkelijk ontleedt; het negatief ion oxideert dan het ammoniumion en het ammoniumion reduceert het negatieve ion.
Een goed voorbeeld hiervan is ammoniumnitraat. Bij verhitting ontstaan lachgas en waterdamp.
Klinische achtergrond
Fysiologisch is 99% van het ammonium in de NH4+ vorm en slechts 1% als vrij ammoniakgas (NH3) aanwezig in het bloed van de mens. Het is alleen het NH3 dat in de hersenen kan komen en daar neurotoxisch kan werken. Het overgrote deel van het ammonium wordt door bacteriën in de dikke darm geproduceerd door inwerking op proteïnen uit voedsel. In het lichaam zelf wordt ammonium gevormd uit omzetting van aminozuren zoals glutaminezuur of door afbraak van alanine in de lever.
In een gezond menselijk lichaam wordt dit ammonium verder omgezet in ureum dat via de urine uitgescheiden kan worden. Bij een verhoogde ammoniak- of ammoniumproductie, of bij een verminderde omzettingscapaciteit van de lever naar ureum, of een slechte nierfunctie kan de overmaat aan stikstof niet uit het lichaam afgevoerd worden. Afhankelijk van de oorzaak kunnen dus verschillende producten gaan ophopen in het lichaam waardoor er langzaam vergiftiging optreedt. Roken is een andere oorzaak van een verhoogd ammoniumgehalte in het bloed. Verhoogde ammoniumwaarden kunnen ook voorkomen bij:
- verhoogd eiwitaanbod
- leverfalen
- nierfunctiestoornissen




