Calciumfosfaat
In de wereld van vandaag is Calciumfosfaat een kwestie die grote relevantie heeft gekregen in de samenleving. Naarmate de tijd vordert, ontdekken we de noodzaak om deze var1 vanuit verschillende perspectieven te onderzoeken en te begrijpen. Het belang van Calciumfosfaat kan niet worden onderschat, aangezien het verschillende aspecten van het dagelijks leven beïnvloedt. Daarom is het van cruciaal belang om dit probleem volledig en objectief aan te pakken om de impact ervan op de hedendaagse samenleving te begrijpen. In dit artikel zullen we Calciumfosfaat en de invloed ervan in diverse contexten in detail analyseren, om een alomvattende en bijgewerkte visie op dit zeer relevante onderwerp te bieden.
| Calciumfosfaat | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
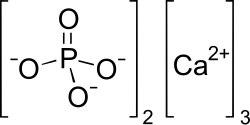
| ||||
Structuur van calciumfosfaat
| ||||
| Algemeen | ||||
| Molecuulformule | Ca3(PO4)2 | |||
| IUPAC-naam | calciumfosfaat, tricalciumbis(fosfaat) | |||
| Andere namen | tricalciumfosfaat, tertiair calciumfosfaat, tricalciumdifosfaat, tribasisch calciumfosfaat, calciumorthofosfaat | |||
| Molmassa | 310,176722 g/mol | |||
| SMILES | P(=O)().P(=O)(). ..
| |||
| InChI | InChI=1/3Ca.2H3O4P/c;;;2*1-5(2,3)4/h;;; 2*(H3,1,2,3,4)/q3*+2;;/p-6/f3Ca.2O4P/q3m;2*-3
| |||
| CAS-nummer | 7758-87-4 | |||
| EG-nummer | 231-840-8 | |||
| PubChem | 24456 | |||
| Wikidata | Q278387 | |||
| LD50 (ratten) | (oraal) > 5000[1] mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 3,14[1] g/cm³ | |||
| Smeltpunt | 1670[1] °C | |||
| Oplosbaarheid in water | 0,02[1] g/L | |||
| Slecht oplosbaar in | water | |||
| Nutritionele eigenschappen | ||||
| ADI | 70 mg/kg lichaamsgewicht | |||
| Type additief | zuurteregelaar, broodverbeteraar, antiklontermiddel | |||
| E-nummer | E341 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Calciumfosfaat is een natuurlijk zout met als brutoformule Ca3(PO4)2. Het komt in de natuur voor als het mineraal whitlockiet. Calciumfosfaat bestaat uit calciumionen en fosfaationen, ionen die veel in het lichaam voorkomen. Het lichaam krijgt deze binnen door het consumeren van zuivel en groente. Beenweefsel bestaat voor een groot deel uit calciumfosfaat.
Calciumfosfaat kan gewonnen worden uit gesteenten. Calciumfosfaat kan ook gesynthetiseerd worden uit fosforzuur.
Het gebruik van calciumfosfaat in het dagelijks leven loopt ver uiteen. Calciumfosfaat wordt bijvoorbeeld gebruikt als zuurteregelaar in voedingsmiddelen en als broodverbeteraar in voeding. Het bindt ook metalen, versterkt antioxidant-activiteit en versterkt de structuur van ingeblikte groenten. Ten slotte wordt het gebruikt als antiklontermiddel en als schuurmiddel in tandpasta. Calciumfosfaat kreeg als voedingsadditief het E-nummer E341(c).
De aanvaardbare dagelijkse inname (ADI) van calcium is maximaal 70 mg/kg lichaamsgewicht.
Calciumfosfaat heeft geen bekende bijwerkingen.