Chloraat
In dit artikel zullen we Chloraat onderzoeken, een fascinerend onderwerp dat de aandacht heeft getrokken van mensen van alle leeftijden en historische contexten. _Var1 is het onderwerp geweest van intense discussies en heeft invloed gehad op de manier waarop we de wereld om ons heen begrijpen. Door middel van een uitgebreide analyse willen we licht werpen op de verschillende aspecten van Chloraat en de impact ervan op de samenleving onderzoeken. Vanaf zijn oorsprong tot zijn evolutie vandaag de dag heeft Chloraat een cruciale rol gespeeld bij het vormgeven van onze culturele, sociale en economische omgeving. Lees verder en ontdek alles wat u moet weten over Chloraat en de relevantie ervan in de wereld van vandaag.
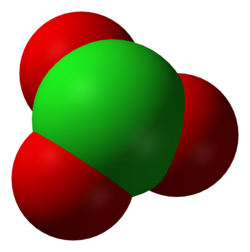

Het chloraat-ion is een oxoanion van chloor, met als brutoformule ClO3−. Chloraten zijn zouten en esters van waterstofchloraat. Bekende chloraten zijn natriumchloraat en kaliumchloraat.
Synthese
Metaalchloraten kunnen worden bereid door chloor aan hete metaalhydroxides (MOH) toe te voegen.
In deze reactie ondergaat chloor een auto-redoxreactie. Chloor (oxidatiegetal 0) vormt chloride (Cl−) met oxidatiegetal -I, en chloraat (ClO3−) met oxidatiegetal +V. Reactie van een koud waterig metaalhydroxide met chloor levert geen chloraat. In plaats daarvan vormt zich het chloride en een hypochloriet.
Structuur
In de meeste gevallen wordt slechts één resonantiestructuur van het chloraation weergegeven. In werkelijkheid zijn echter alle Cl-O-bindingen identiek, wat tot uitdrukking komt in de gelijke lengte van alle bindingen:
Het ion neemt een trigonaal piramidale structuur aan.
Eigenschappen
Chloraten zijn krachtige oxidatoren. Mengsels van chloraten met reductoren werden daarom vroeger als explosief en ontstekingsmiddel gebruikt. Tegenwoordig gebruikt men de stoffen vanwege de wrijvingsgevoeligheid en de neiging tot spontane reactie niet meer voor deze doeleinden.
Chloraten zijn tamelijk toxisch. Dit in tegenstelling tot de doorgaans onschadelijke chloriden die voortkomen uit reductie van chloraten.

