Gebogen moleculaire geometrie
Het thema van Gebogen moleculaire geometrie heeft de aandacht getrokken van mensen van alle leeftijden en lagen van de bevolking. Van zijn impact op de samenleving tot zijn invloed op de entertainmentwereld: Gebogen moleculaire geometrie heeft op de een of andere manier zijn sporen nagelaten. In dit artikel zullen we de verschillende facetten van Gebogen moleculaire geometrie onderzoeken en het belang ervan in ons dagelijks leven analyseren. Door middel van interviews met experts op dit gebied en relevante casestudies zullen we proberen licht te werpen op dit onderwerp dat vandaag de dag zo relevant is. Zonder enige twijfel is Gebogen moleculaire geometrie een fundamenteel aspect dat zorgvuldig onderzoek verdient. Dus bereid je voor op een diepe duik in Gebogen moleculaire geometrie en alles wat het te bieden heeft.
| Gebogen moleculaire geometrie | ||||
|---|---|---|---|---|
| Ruimtelijke structuur | ||||
| ||||
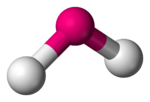
Ruimtelijke schikking van de atomen
| ||||
| ||||
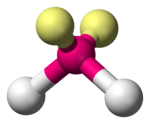
■ twee vrije elektronenparen | ||||

| ||||
■ één vrij elektronenpaar | ||||
| Eigenschappen | ||||
| Puntgroep | C2v | |||
| Bindende elektronenparen | 2 | |||
| Vrije elektronenparen | 1 of 2 | |||
| Bindingshoeken | 120° of 109,5° | |||
| Coördinatiegetal | 2 | |||
| AXE-symbool | geknikt: AX2E1 gebogen: AX2E2 | |||
| ||||
In de scheikunde verwijst een gebogen moleculaire geometrie ernaar, dat een molecuul een geometrie heeft waarbij drie atomen via twee bindingen met elkaar zijn verbonden en waarbij deze twee bindingen een hoek kleiner dan 180° maken. Water heeft deze moleculaire geometrie, waarbij de twee O-H-bindingen een hoek van 104,45° maken. Andere voorbeelden zijn stikstofdioxide, waterstofselenide en zwaveldichloride.
Het centrale atoom van deze verbindingen heeft meestal een binding met twee vrije elektronenparen. In het geval dat het centrale element een binding met maar één vrij elektronenpaar heeft, wordt soms van een geknikte structuur gesproken, omdat de bindingshoek groter is. Die is dan 120°. Zwaveldioxide is hiervan een voorbeeld.