Natriumcarbonaat
In de wereld van vandaag is Natriumcarbonaat een onderwerp geworden dat van groot belang is voor een breed scala aan mensen. Of het nu gaat om een debat over het belang van Natriumcarbonaat in de moderne samenleving, de impact van Natriumcarbonaat op de economie, of simpelweg de fascinatie voor de geschiedenis van Natriumcarbonaat, dit onderwerp heeft de aandacht van velen getrokken. Bovendien heeft Natriumcarbonaat eindeloos onderzoek, debatten en discussies opgeleverd die hebben geleid tot een beter begrip en waardering van het belang ervan. In dit artikel zullen we de impact van Natriumcarbonaat grondig onderzoeken, verschillende perspectieven analyseren en een alomvattend beeld geven van dit onderwerp dat vandaag de dag zo relevant is.
| Natriumcarbonaat | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
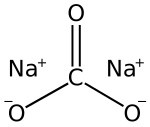
| ||||
Structuurformule van natriumcarbonaat
| ||||

| ||||
Natriumcarbonaat-poeder
| ||||
| Algemeen | ||||
| Molecuulformule | Na2CO3 | |||
| IUPAC-naam | natriumcarbonaat | |||
| Andere namen | soda | |||
| Molmassa | 105,988439 g/mol | |||
| SMILES | C(=O)()..
| |||
| InChI | 1S/CH2O3.2Na/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2
| |||
| CAS-nummer | 497-19-8 | |||
| EG-nummer | 207-838-8 | |||
| PubChem | 5463866 | |||
| Wikidata | Q190227 | |||
| Vergelijkbaar met | natriumwaterstofcarbonaat, kaliumcarbonaat | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H319 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P305+P351+P338 | |||
| Hygroscopisch? | ja | |||
| LD50 (ratten) | (oraal) 4090 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 2,532 g/cm³ | |||
| Smeltpunt | 851 °C | |||
| Oplosbaarheid in water | 300 g/L | |||
| Goed oplosbaar in | water | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Natriumcarbonaat, ook wel bekend als soda, is een anorganische verbinding met als brutoformule Na2CO3. De zuivere stof komt voor als een wit hygroscopisch poeder, dat goed oplosbaar is in water.
Geschiedenis
Voordat natriumcarbonaat in grote hoeveelheden ter beschikking kwam gebruikte men potas. Dit was echter niet in zuivere vorm voorhanden, maar aanwezig in houtas. Om dit te vervaardigen had men buitengewoon veel hout nodig, hetgeen leidde tot ontbossing op grote schaal en tot een schaarste aan houtas.
Aldus zocht men in de tweede helft van de 18e eeuw naar een proces om natriumcarbonaat, dat potas kon vervangen, uit natriumchloride te vervaardigen. Dit leidde tot het Leblancproces, dat voor het eerst werd toegepast in 1791. Dit leidde tot een uitgebreide soda-industrie waardoor glas, textiel en ook zeep veel goedkoper en in grotere hoeveelheden te vervaardigen was. Soda was ook een belangrijk handelsproduct.
Het vrijkomen van een aantal nevenproducten deed de vraag naar betere processen ontstaan en de ontwikkeling van het Solvayproces in 1861 bood uitkomst. Sedertdien verdrong het Solvayproces geleidelijk het Leblancproces.
Synthese
Het Belgische bedrijf Solvay is wereldwijd een van de belangrijkste producenten en het Solvayproces wordt het meest toegepast bij de productie van natriumcarbonaat. Het proces is opgebouwd uit verschillende stappen. In de eerste stap wordt calciumcarbonaat (dat uit kalksteen wordt gewonnen) onder invloed van warmte omgezet in calciumoxide en koolstofdioxide:
Koolstofdioxide wordt samen met ammoniak door een geconcentreerde oplossing van natriumchloride geleid, waardoor natriumwaterstofcarbonaat wordt gevormd:
Het gevormde natriumwaterstofcarbonaat wordt verhit tot ca. 200°C, waardoor water en koolstofdioxide afgesplitst worden. Dit proces wordt calcinatie of calcineren genoemd.
In de laatste stap wordt ammoniak teruggewonnen en teruggevoerd naar de tweede stap:
Het hierbij gevormde calciumchloride wordt verkocht als nevenproduct.
Eigenschappen
In watervrije toestand is natriumcarbonaat een witte vaste stof met een smeltpunt van 851°C. Het zout is vrij hygroscopisch en vormt verscheidene hydraten:
- Monohydraat (Na2CO3 · H2O), dat zich bij temperaturen boven 35,4°C uit het heptahydraat vormt. Bij temperaturen boven 107°C gaat het monohydraat in het watervrije natriumcarbonaat over.
- Heptahydraat (Na2CO3 · 7 H2O), dat zich bij temperaturen boven 32,5°C uit het decahydraat vormt.
- Decahydraat (Na2CO3 · 10 H2O), dat bij temperaturen beneden 32,5°C uit een verzadigde natriumcarbonaat-oplossing uitkristalliseert. Boven deze temperatuur lossen de kristallen zich in hun eigen kristalwater op. Het decahydraat bezit een dichtheid van 1,45 g/cm³.
Natriumcarbonaat reageert met zuren, waardoor koolstofdioxide gevormd wordt:
In water lost het met een grote daling van temperatuur op en vormt een sterk basische oplossing. Vóór de productie van natriumhydroxide was natriumcarbonaat de belangrijkste toegepaste base.
Natriumcarbonaat reageert met vocht en koolstofdioxide uit de lucht, met vorming van natriumwaterstofcarbonaat:
Toepassingen
Er werd wereldwijd in 1997 ongeveer 39 miljoen ton natriumcarbonaat geproduceerd. Het grootste deel hiervan wordt afgezet in vijf industrieën:
- De glasindustrie is de grootste verbruiker van natriumcarbonaat. In de glasblazerijen wordt het aan gesmolten glas toegevoegd om de eigenschappen (zoals breekbaarheid en helderheid) van het glas te verbeteren. Glasfabrieken voegen natriumcarbonaat aan het mengsel toe om het smeltpunt van het mengsel te verlagen (eutecticum).
- De chemische industrie benut natriumcarbonaat voor de productie van onder andere bleekmiddelen, verven, vulstoffen, leerlooierij-chemicaliën, reinigingsmiddelen, lijm- en kleefstoffen en metaalcarbonaten.
- In ijzergieterijen wordt natriumcarbonaat gebruikt bij de ontzwaveling van ruwijzer, gietijzer en staal en als flotatie- en vloeimiddel.
- In de wasmiddel- en zeepindustrie worden met natriumcarbonaat wasmiddelen en andere reinigingsmiddelen gemaakt en wordt het gebruikt om vetten te verzepen.
- In de papier- en celluloseindustrie wordt natriumcarbonaat zowel gebruikt voor ontsluiting, neutralisatie, reinigingen en bleken van papier en het opwerken van oud papier.
- Natriumcarbonaat wordt veelal ook bijgeleverd in een strooizakje bij de aankoop van snijbloemen. Na het toevoegen aan het water bij snijbloemen zorgt het voor een vertraging in het bloeiproces van de bloemen, waardoor deze langer in bloei staan.
Daarnaast wordt natriumcarbonaat, opgelost in warm water, vaak gebruikt om kleine wondjes aan handen of voeten te ontsmetten en ontstekingen te bestrijden. Tegenwoordig wordt dit afgeraden. Ook wordt het gebruikt om een te lage pH van zwembadwater te verhogen. Het is in de winkel te vinden als zilversoda, kristalsoda of huishoudsoda. Niet te verwarren met baksoda of zuiveringszout.
Zie ook
Externe links
- (en) Gegevens van natriumcarbonaat in de GESTIS-stoffendatabank van het IFA
- (en) MSDS van natriumcarbonaat






